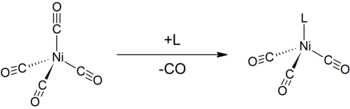Nickel tetracarbonyl
| Niken tetracacbonyl | |||
|---|---|---|---|
| |||
 Cấu trúc 2D của niken tetracacbonyl
| |||
| Danh pháp IUPAC | Tetracarbonylnickel | ||
| Tên khác | Niken tetracacbonyl Niken(0) tetracacbonyl |
||
| Nhận dạng | |||
| Số CAS | 13463-39-3 | ||
| PubChem | 26039 | ||
| Số EINECS | 236-669-2 | ||
| ChEBI | 30372 | ||
| Số RTECS | QR6300000 | ||
| Ảnh Jmol-3D | ảnh | ||
| SMILES | đầy đủ
|
||
| InChI | đầy đủ
|
||
| ChemSpider | 24253 | ||
| Tham chiếu Beilstein | 6122797 | ||
| Tham chiếu Gmelin | 3135 | ||
| Thuộc tính | |||
| Công thức phân tử | Ni(CO)4 | ||
| Khối lượng mol | 171,0046 g/mol | ||
| Bề ngoài | chất lỏng không màu | ||
| Mùi | mùi mốc, như bụi gạch | ||
| Khối lượng riêng | 1,319 g/cm³ | ||
| Điểm nóng chảy | −17,2 °C (256,0 K; 1,0 °F) | ||
| Điểm sôi | 43 °C (316 K; 109 °F) | ||
| Độ hòa tan trong nước | 18 mg/100mL (10 °C) | ||
| Độ hòa tan | tan trong nhiều dung môi hữu cơ hòa tan trong axit nitric, nước cường toan |
||
| Áp suất hơi | 315 mmHg (20 °C) | ||
| Độ nhớt | 3,05 x 10−4 Pa s | ||
| Cấu trúc | |||
| Tọa độ | Tứ phương | ||
| Hình dạng phân tử | Tứ phương | ||
| Mômen lưỡng cực | không | ||
| Nhiệt hóa học | |||
|
Enthalpy hình thành ΔfH |
−632 kJ/mol | ||
| DeltaHc | −1180 kJ/mol | ||
|
Entropy mol tiêu chuẩn S |
320 J K−1 mol−1 | ||
| Các nguy hiểm | |||
| NFPA 704 |
|
||
| Giới hạn nổ | 2–34% | ||
| PEL | TWA 0,001 ppm (0,007 mg/m³) | ||
| REL | TWA 0,001 ppm (0,007 mg/m³) | ||
| IDLH | Ca [2 ppm] | ||
| Ký hiệu GHS |
   
|
||
| Chỉ dẫn nguy hiểm GHS | H225, H300, H310, H330, H351, H360D, H410 | ||
| Chỉ dẫn phòng ngừa GHS | P201, P202, P210, P233, P240, P241, P242, P243, P260, P271, P273, P280, P281, P284, P303+P361+P353, P304+P340, P308+P313, P310, P320, P370+P378, P391, P403+P233, P403+P235, P405, P501 | ||
| Các hợp chất liên quan | |||
| Nhóm chức liên quan |
Sắt pentacacbonyl Đicoban octacacbonyl |
||
|
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |||
Niken tetracacbonyl (các tên gọi khác: niken(0) tetracacbonyl, niken cacbonyl), là hợp chất cộng hóa trị của niken, nó là bất thường đối với các hợp chất của kim loại này, ở nhiệt độ phòng nó là một chất lỏng không màu. Công thức hóa học của nó là Ni(CO)4. Nó là một chất cực độc trong ngành hóa học niken và có thể gây nguy hiểm cho tính mạng nếu uống nhầm hay qua đường da, do đó nó còn có tên gọi khác là "chất lỏng chết chóc". Niken tetracacbonyl cực kỳ dễ bay hơi. Nó bay hơi ngay ở nhiệt độ phòng. Hơi của nó có thể tự kích cháy ở nhiệt độ 60 °C (140 °F; 333 K). Hơi nickel carbonyl rất độc hại, hít là chết.
Giống như sắt pentacacbonyl, niken tetracacbonyl là hợp chất có 18 cộng hóa trị.
Niken kim loại ở nhiệt độ phòng có thể phản ứng với cacbon monoxit (CO) để tạo ra niken tetracacbonyl. Khi bị nung nóng nhẹ thì niken tetracacbonyl bị phân hủy tạo ra cacbon oxit và niken kim loại. Hai phản ứng này tạo thành cơ sở cho quy trình Mond để sản xuất niken tinh khiết.
Cấu trúc và liên kết
Trong niken tetracacbonyl, trạng thái oxy hóa của niken được coi là bằng 0. Công thức là phù hợp với quy tắc 18 điện tử. Phân tử là tứ phương, với 4 phối tử cacbonyl (cacbon monoxit). Các nghiên cứu nhiễu xạ electron đã được thực hiện với phân tử này, và các khoảng cách Ni–C và C–O được tính toán tương ứng là 1,838(2) và 1,141(2) Å.
Điều chế
Ni(CO)4 được Ludwig Mond tổng hợp lần đầu tiên năm 1890 bằng phản ứng trực tiếp của niken kim loại với CO. Công trình tiên phong này báo trước sự tồn tại của nhiều hợp chất cacbonyl kim loại khác, bao gồm các hợp chất của vanadi, crom, mangan, sắt và coban. Nó được sử dụng ở quy mô công nghiệp để tinh chế niken vào cuối thế kỷ 19.
Người ta cho cacbon monoxit qua niken không tinh khiết ở nhiệt độ từ 50 °C (323 K; 122 °F) trở lên. Tốc độ tối ưu diễn ra ở 130 °C.
Phòng thí nghiệm
Ni(CO)4 không có sẵn ở quy mô thương mại. Nó được điều chế trong phòng thí nghiệm bằng cacbonyl hóa bis(cyclooctadien)niken(0) có sẵn ở quy mô thương mại. Nó cũng có thể điều chế bằng phản ứng khử dung dịch amonia của niken(II) sunfat với natri đithionit trong môi trường khí CO.
Phản ứng

Khử cacbonyl nhiệt
Khi nung nóng nhẹ thì Ni(CO)4 phân hủy thành cacbon monoxit và niken kim loại. Kết hợp với sự hình thành dễ dàng từ CO và ngay cả niken không tinh khiết, sự phân hủy này là cơ sở cho quy trình Mond để tinh chế niken. Sự phân hủy nhiệt diễn ra ở 180 °C và tăng lên theo nhiệt độ.
Phản ứng với tác nhân ưa hạt nhân và tác nhân khử
Giống như các cacbonyl kim loại khác, Ni(CO)4 dễ bị tấn công bởi các tác nhân ưa hạt nhân. Sự tấn công có thể xảy ra ở niken trung tâm dẫn tới sự thay thế phối tử CO, hoặc tại CO. Vì thế, các phối tử cho như triphenylphotphin phản ứng để tạo ra Ni(CO)3(PPh3) và Ni(CO)2(PPh3)2. Bipyridin và các phối tử có liên quan có phản ứng tương tự. Sự thay thế đơn của niken tetracacbonyl với các phối tử khác có thể sử dụng để xác định tham số electron Tolman, một phép đo khả năng cho hay rút electron của một phối tử nào đó.
Xử lý với các hydroxide tạo ra các cụm như [Ni5(CO)12]2− và [Ni6(CO)12]2−. Các hợp chất này cũng có thể thu được bằng cách khử niken cacbonyl.
Vì thế, xử lý Ni(CO)4 với các chất ưa hạt nhân cacbon (Nu−) tạo ra các dẫn xuất acyl, như [Ni(CO)3C(O)Nu)]−.
Phản ứng với tác nhân ưa điện tử và tác nhân oxy hóa
Niken cacbonyl cũng có thể bị oxy hóa. Clo oxy hóa niken cacbonyl thành NiCl2, giải phóng khí CO. Các halogen khác có phản ứng tương tự. Phản ứng này là phương pháp thuận tiện để tiêu hủy phần không mong muốn còn lại của hợp chất độc hại này.
Phản ứng của Ni(CO)4 với alkyl và aryl halide thường tạo ra các sản phẩm hữu cơ cacbonyl hóa. Các halide vinyl, như PhCH=CHBr, được chuyển thành các este chưa bão hòa bằng xử lý với Ni(CO)4 và sau đó là bằng natri metoxit (CH3ONa). Các phản ứng như vậy cũng có thể tiến hành thông qua phản ứng cộng oxy hóa. Các haua allyl tạo ra các hợp chất π-allyl niken, như (allyl)2Ni2Cl2:
- 2Ni(CO)4 + 2ClCH2CH=CH2 → Ni2(μ-Cl)2(η3-C3H5)2 + 8CO↑
Độc tính
Biểu hiện ngộ độc niken tetracacbonyl được đặc trưng bởi hai giai đoạn của bệnh. Giai đoạn thứ nhất bao gồm đau đầu và tức ngực kéo dài vài giờ, thông thường được nối tiếp bằng sự thuyên giảm ngắn. Giai đoạn hai là viêm phổi do hóa chất, thông thường nó bắt đầu sau khoảng 16 giờ với các triệu chứng như ho, khó thở và cực kỳ mệt mỏi. Các triệu chứng này đạt đến độ nguy hiểm cao nhất sau khoảng 4 ngày, có thể gây tử vong do tổn thương tim mạch-hệ hô hấp hay suy thận cấp tính. Sự hồi phục thường là rất kéo dài, hay bị phức tạp hóa do sự kiệt sức, suy nhược và khó thở khi cố sức. Tổn thương vĩnh cửu hệ hô hấp là bất thường. Hiện vẫn còn tranh cãi về khả năng gây ung thư của niken tetracacbonyl dạng khí. Tiêu chuẩn IDLH (NIOSH) là vào khoảng 2 ppm (14 mg/m³).
Liên kết ngoài
- Thẻ an toàn hóa chất số 0064
- Hướng dẫn bỏ túi của NIOSH về các nguy hiểm hóa chất
- Ủy ban hóa chất châu Âu Lưu trữ 2011-07-22 tại Wayback Machine
- Chuyên khảo của IARC về "Niken và các hợp chất của niken" Lưu trữ 2005-10-12 tại Wayback Machine
- Cơ sở tham chiếu tiêu chuẩn của NIST