
Carbon dioxide
| Carbon dioxide | |
|---|---|
 Cấu trúc phân tử của carbon dioxide
| |
| Tổng quan | |
| Danh pháp IUPAC | carbon dioxide |
| Tên khác | khí carbonic thán khí carbonic oxide carbon(IV) oxide anhydride carbonic băng khô (rắn) khí ga (gas) |
| Công thức phân tử | CO2 |
| Phân tử gam | 44,0098 g/mol |
| Biểu hiện | Chất khí không màu, không mùi |
| Số CAS | [124-38-9] |
| Thuộc tính | |
| Tỷ trọng và pha | 1,98 kg/m³ ở 298 K 1,6 g/cm³ (rắn) |
| Độ hòa tan trong nước | 1,45 kg/m³ |
| Nhiệt độ nóng chảy | −57 °C (−71 °F; 216 K) (áp lực) |
| Điểm sôi | −78 °C (−108 °F; 195 K) (thăng hoa) |
| pKa | 6,35 và 10,33 |
| pKb | không rõ |
| Độ nhớt | 0,07 cP ở -78 °C |
| Khác | |
| MSDS | MSDS ngoài |
| Các nguy hiểm chính | Ngạt thở Kích thích |
| NFPA 704 |
|
| Điểm bắt lửa | Không cháy |
| Rủi ro/An toàn | R: As, Fb S: 9, 23, 36a (lỏng) |
| Số RTECS | FF6400000 |
| Dữ liệu hóa chất bổ sung | |
| Cấu trúc & thuộc tính | n εr, v.v. |
| Dữ liệu nhiệt động lực | Các trạng thái rắn, lỏng, khí |
| Dữ liệu quang phổ | UV, IR, NMR, MS |
| Các hợp chất liên quan | |
| Các hợp chất tương tự | Metan |
| Các hợp chất liên quan |
Carbon Carbon monoxide Carbonat Carbon trioxide |
| Ngoại trừ có thông báo khác, các dữ liệu được lấy ở 25 °C, 100 kPa Thông tin về sự phủ nhận và tham chiếu | |
Carbon dioxide hay carbonic oxide (tên gọi khác: thán khí, anhydride carbonic, khí carbonic) là một hợp chất ở điều kiện bình thường có dạng khí trong khí quyển Trái Đất, bao gồm một nguyên tử carbon và hai nguyên tử oxy. Là một hợp chất hóa học được biết đến rộng rãi, nó thường xuyên được gọi theo công thức hóa học là CO2. Trong dạng rắn, nó được gọi là băng khô hoặc đá khô.
Carbon dioxide thu được từ nhiều nguồn khác nhau, bao gồm cả khí thoát ra từ các núi lửa, sản phẩm cháy của các hợp chất hữu cơ và hoạt động hô hấp của các sinh vật sống hiếu khí. Nó cũng được một số vi sinh vật sản xuất từ sự lên men và sự hô hấp của tế bào. Các loài thực vật hấp thụ carbon dioxide trong quá trình quang hợp, và sử dụng cả carbon và oxy để tạo ra các carbohydrat. Ngoài ra, thực vật cũng giải phóng oxy trở lại khí quyển, oxy này sẽ được các sinh vật dị dưỡng sử dụng trong quá trình hô hấp, tạo thành một chu trình. Nó có mặt trong khí quyển Trái Đất với nồng độ thấp và tác động như một khí gây hiệu ứng nhà kính. Nó là thành phần chính trong chu trình carbon.
Các thuộc tính hóa-lý
Carbon dioxide là một khí không màu mà khi hít thở phải ở nồng độ cao (nguy hiểm do nó gắn liền với rủi ro ngạt thở) tạo ra vị chua trong miệng và cảm giác nhói ở mũi và cổ họng. Các hiệu ứng này là do khí hòa tan trong màng nhầy và nước bọt, tạo ra dung dịch yếu của acid carbonic.
Tỷ trọng riêng của nó ở 25 °C là 1,98 kg·m−3, nặng hơn khoảng 1,5 lần không khí. Phân tử carbon dioxide (O = C = O) chứa hai liên kết đôi và có hình dạng tuyến tính. Nó không có lưỡng cực điện. Do nó là hợp chất đã bị oxy hóa hoàn toàn nên về mặt hóa học nó không hoạt động lắm và cụ thể là không cháy.
Ở nhiệt độ dưới -78 °C, carbon dioxide ngưng tụ lại thành các tinh thể màu trắng gọi là băng khô. Carbon dioxide lỏng chỉ được tạo ra dưới áp suất trên 5,1 bar; ở điều kiện áp suất khí quyển, nó chuyển trực tiếp từ các pha khí sang rắn hay ngược lại theo một quá trình gọi là thăng hoa.
Nước sẽ hấp thụ một lượng nhất định carbon dioxide, và nhiều hơn lượng này khi khí bị nén. Khoảng 1% carbon dioxide hòa tan chuyển hóa thành acid carbonic. Acid carbonic phân ly một phần thành các ion bicarbonat (HCO3−) và carbonat (CO32−).
Khi một nguồn lửa được đưa vào ống thử có chứa carbon dioxide thì ngọn lửa sẽ tắt ngay lập tức do carbon dioxide thông thường không duy trì sự cháy, tuy nhiên nếu là sự cháy của các kim loại mang tính khử cao như Mg, Zn thì carbon bị khử, tạo ra Oxide kim loại và muội than. (Một số loại bình cứu hỏa chứa carbon dioxide hay các chất khi phản ứng với nhau sẽ tạo ra nó dùng để dập lửa). Để xác nhận tiếp theo là khí này là carbon dioxide thì khí được dẫn qua dung dịch calci hydroxide (Ca(OH)2) trong. Dung dịch calci hydroxide sẽ chuyển thành kết tủa màu trắng do sự tạo thành calci carbonat (CaCO3).
Sử dụng
Carbon dioxide lỏng và rắn là chất làm lạnh quan trọng, đặc biệt là trong công nghiệp thực phẩm, trong đó chúng tham gia vào quá trình lưu trữ và vận chuyển các loại kem lạnh và các thực phẩm đông lạnh.
Carbon dioxide được sử dụng để sản xuất nước giải khát carbonat hóa và nước soda. Theo truyền thống, quá trình carbonat hóa trong bia và vang nổ có được do lên men tự nhiên, nhưng một số nhà sản xuất carbonat hóa các đồ uống này một cách nhân tạo.
Bột nở sử dụng trong các loại bánh nướng tạo ra khí carbonic làm cho khối bột bị phình to ra, do tạo ra các lỗ xốp chứa bọt khí. Men bánh mì tạo ra khí carbonic bằng sự lên men trong khối bột, trong khi các loại bột nở hóa học giải phóng ra khí carbonic khi bị nung nóng hoặc bị tác dụng với các acid.
Carbon dioxide thông thường cũng được sử dụng như là khí điều áp rẻ tiền, không cháy. Các áo phao cứu hộ thông thường chứa các hộp nhỏ chứa carbon dioxide đã nén để nhanh chóng thổi phồng lên. Các ống thép chứa carbonic nén cũng được bán để cup cấp khí nén cho súng hơi, bi sơn, bơm lốp xe đạp, cũng như để làm nước khoáng xenxe. Sự bốc hơi nhanh chóng của carbon dioxide lỏng được sử dụng để gây nổ trong các mỏ than.
Carbon dioxide dập tắt lửa, và một số bình cứu hỏa, đặc biệt là các loại được thiết kể để dập cháy do điện, có chứa carbon dioxide lỏng bị nén. carbon dioxide cũng được sử dụng như là môi trường khí cho công nghệ hàn, mặc dù trong hồ quang thì nó phản ứng với phần lớn các kim loại. Nó được sử dụng rộng rãi trong công nghiệp ô tô mặc dù có chứng cứ đáng kể cho thấy khi hàn trong môi trường này thì mối hàn giòn hơn so với các mối hàn trong môi trường các khí trơ, và các mối hàn này theo thời gian sẽ giảm phẩm cấp do sự tạo thành của axít carbonic. Nó được sử dụng làm việc này chủ yếu là do nó rẻ tiền hơn nhiều so với các khí trơ như agon hay heli.
Carbon dioxide lỏng là một dung môi tốt cho nhiều hợp chất hữu cơ, và được dùng để loại bỏ cafein từ cà phê. Nó cũng bắt đầu nhận được sự chú ý của công nghiệp dược phẩm và một số ngành công nghiệp chế biến hóa chất khác do nó là chất thay thế ít độc hơn cho các dung môi truyền thống như các chloride hữu cơ (xem hóa học xanh).
Thực vật cần có carbon dioxide để thực hiện việc quang hợp, và các nhà kính có thể được làm giàu bầu khí quyển của chúng bằng việc bổ sung CO2 nhằm kích thích sự tăng trưởng của thực vật. Người ta cũng đề xuất ý tưởng cho carbon dioxide từ các nhà máy nhiệt điện đi qua các ao để phát triển tảo và sau đó chuyển hóa chúng thành nguồn nhiên liệu điezen sinh học. Nồng độ cao của carbon dioxide trong khí quyển tiêu diệt có hiệu quả nhiều loại sâu hại. Các nhà kính được nâng nồng độ CO2 tới 10.000 ppm (1%) trong vài giờ để tiêu diệt các loại sâu bệnh như rầy trắng (họ Aleyrodidae), nhện v.v.
Trong y học, tới 5% carbon dioxide được thêm vào oxy nguyên chất để trợ thở sau khi ngừng thở và để ổn định cân bằng O2/CO2 trong máu.
Một dạng phổ biến của laser khí công nghiệp là laze carbon dioxide, sử dụng carbon dioxide làm môi trường.
Carbon dioxide cũng hay được bơm vào hay gần với các giếng dầu. Nó có tác dụng như là tác nhân nén và khi hòa tan trong dầu thô dưới lòng đất thì nó làm giảm đáng kể độ nhớt của dầu thô, tạo điều kiện để dầu chảy nhanh hơn trong lòng đất vào các giếng hút. Trong các mỏ dầu đã hoàn thiện thì một hệ thống ống đồ sộ được sử dụng để chuyển carbon dioxide tới các điểm bơm.
Băng khô
Băng khô là tên gọi cho carbon dioxide rắn (đóng băng). Thuật ngữ này được Prest Air Devices tạo ra năm 1925 (công ty thành lập năm 1923 tại thành phố Long Island, New York).
Băng khô, dưới áp suất thường, không nóng chảy thành carbon dioxide lỏng mà thăng hoa trực tiếp thành dạng khí ở -78,5 °C (-109,3 °F). Vì thế nó được gọi là "băng khô" như là cách gọi để so sánh với băng "ướt" (nước đá thông thường).
Băng khô được sản xuất bằng cách nén khí carbon dioxide thành dạng lỏng, loại bỏ nhiệt gây ra bởi quá trình nén (xem định luật Charles), và sau đó cho carbon dioxide lỏng giãn nở nhanh. Sự giãn nở này làm giảm nhiệt độ và làm cho một phần CO2 bị đóng băng thành "tuyết", sau đó "tuyết" này được nén thành các viên hay khối.
Sử dụng

- Làm lạnh thực phẩm, các mẫu sinh học và các mặt hàng mau hỏng khác.
- Sản xuất "sương mù băng khô" để tạo các hiệu ứng đặc biệt. Khi băng khô tiếp xúc với nước thì carbon dioxide đóng băng thăng hoa thành hỗn hợp khí carbon dioxide lạnh và không khí lạnh ẩm ướt. Điều này sinh ra sự ngưng tụ và hình thành sương mù; xem thêm máy tạo sương mù. Hiệu ứng sương mù của hỗn hợp băng khô với nước được tạo ra tốt nhất là với nước ấm.
- Các viên nhỏ băng khô (thay vì cát) được bắn vào bề mặt cần làm sạch. Băng khô không cứng như cát, nhưng nó tăng tốc quá trình bằng sự thăng hoa để "không còn gì" tồn tại trên bề mặt cần làm sạch và gần như không tạo ra nhiều bụi gây hại phổi.
- Tăng gây mưa từ các đám mây hay làm giảm độ dày của mây nhờ sự kết tinh nước trong mây.
- Sản xuất khí carbon dioxide do cần thiết trong các hệ thống như thùng nhiên liệu hệ thống trơ trong các máy bay B-47.
- Các ống lót trục bằng đồng thau hay kim loại khác được cho vào băng khô để làm chúng co lại sao cho chúng sẽ khớp với kích thước trong của lỗ trục. Khi các ống lót này ấm trở lại, chúng nở ra và trở nên cực kỳ khít nhau.
Tiếp xúc
Do các đặc trưng cụ thể của mình, băng khô đòi hỏi phải có sự phòng ngừa đặc biệt khi tiếp xúc. Nó cực lạnh vì vậy không nên cho tiếp xúc trực tiếp với da (nghĩa là cần đeo găng cách nhiệt thích hợp). Nó thường xuyên thăng hoa thành khí carbonic, vì thế nó không thể lưu trữ trong các thùng chứa có nắp đậy do áp suất tạo ra sẽ nhanh chóng phá vỡ thùng do bị nổ. Khí thăng hoa cần thông gió tốt; nếu không nó có thể tràn ngập không gian quanh đó và làm cho người ta nghẹt thở. Sự quan tâm đặc biệt đối với các thiết bị thông gió là cần thiết. Những người tiếp xúc với băng khô cần phải được cảnh báo là carbon dioxide nặng hơn không khí và sẽ chìm xuống dưới sàn. Một số thị trường đòi hỏi những người mua băng khô phải từ 18 tuổi trở lên.
Sinh học
Carbon dioxide là sản phẩm cuối cùng trong cơ thể sinh vật có sự tích lũy năng lượng từ việc phân hủy đường hay chất béo với oxy như là một phần của sự trao đổi chất của chúng, trong một quá trình được biết đến như là sự hô hấp của tế bào. Nó bao gồm tất cả các loài thực vật, động vật, nhiều loại nấm và một số vi khuẩn. Trong các động vật bậc cao, carbon dioxide di chuyển trong máu từ các mô của cơ thể tới phổi và ở đây nó bị thải ra ngoài.
Hàm lượng carbon dioxide trong không khí trong lành là khoảng 0,04%, và trong không khí bị thải ra từ sự thở là khoảng 4,5%. Khi thở trong không khí với nồng độ cao (khoảng 5% theo thể tích), nó là độc hại đối với con người và các động vật khác.
Hemoglobin, phân tử chuyên chở oxy chính trong hồng cầu, có thể chở cả oxy và carbon dioxide, mặc dù theo các cách thức hoàn toàn khác nhau. Sự suy giảm liên kết với oxy trong máu do sự tăng mức carbon dioxide được biết đến như là hiệu ứng Haldane, và nó là quan trọng trong việc vận chuyển carbon dioxide từ các mô tới phổi. Ngược lại, sự tăng áp suất thành phần của CO2 hay pH thấp hơn sẽ sinh ra sự rút bớt oxy từ hemoglobin. Hiệu ứng này gọi là hiệu ứng Bohr.
Theo nghiên cứu của USDA , sự thở của một người trung bình mỗi ngày sinh ra khoảng 450 lít (khoảng 900 gam) carbon dioxide.
CO2 được vận chuyển trong máu theo ba cách khác nhau. Phần lớn trong chúng (khoảng 80%–90%) được các enzym carbonic anhydraz chuyển hóa thành các ion bicarbonat HCO3− trong các tế bào hồng cầu. 5%–10% được hòa tan trong huyết tương và 5%–10% liên kết với hemoglobin thành các hợp chất carbamin. Phần trăm chính xác phụ thuộc vào đó là máu ở động mạch hay tĩnh mạch.
Hemoglobin liên kết với CO2 không giống như liên kết với oxy; CO2 liên kết với các nhóm chứa N trên 4 chuỗi globin. Tuy nhiên, do các hiệu ứng khác khu vực hoạt hóa trên phân tử hemoglobin, liên kết của CO2 làm giảm lượng oxy được liên kết đối với áp suất thành phần nhất định của oxy.
Carbon dioxide có thể là một trong các chất trung gian để tự điều chỉnh việc cung cấp máu theo khu vực. Nếu nồng độ của nó cao thì các mao mạch nở ra để cho nhiều máu hơn đến các mô.
Các ion bicarbonat là chủ yếu trong việc điều chỉnh pH của máu. Do tần suất thở có ảnh hưởng tới mức CO2 trong máu, nên nhịp thở quá chậm hay quá nông sẽ sinh ra hiện tượng toan hô hấp, trong khi nhịp thở quá nhanh gây nên thở nhanh sẽ dẫn đến kiềm hô hấp.
Một điều thú vị là mặc dù oxy là chất cần thiết của quá trình trao đổi chất của cơ thể, nhưng không phải nồng độ thấp của oxy kích thích sự hô hấp mà lại là nồng độ cao của carbon dioxide. Kết quả là, sự hô hấp trong không khí loãng (áp suất thấp) hay hỗn hợp khí không có oxy (ví dụ nitơ nguyên chất) dẫn đến sự bất tỉnh mà không cần có các vấn đề về hệ hô hấp của cá thể đó. Nó là đặc biệt nguy hiểm cho các phi công lái máy bay chiến đấu bay ở cao độ lớn, và nó cũng là lý do giải thích tại sao các hướng dẫn tại các máy bay thương mại trong trường hợp sụt áp suất trong khoang thì người ta cần phải sử dụng mặt nạ thở oxy cho chính mình trước khi giúp người khác—nếu không thì chính người đó sẽ chịu rủi ro bất tỉnh mà không hề được cảnh báo trước về nguy hiểm sắp xảy ra.
Thực vật hấp thụ carbon dioxide từ khí quyển trong quá trình quang hợp. Carbon dioxide được thực vật (với năng lượng từ ánh sáng Mặt Trời) sử dụng để sản xuất ra các chất hữu cơ bằng tổ hợp nó với nước. Các phản ứng này giải phóng ra oxy tự do. Đôi khi carbon dioxide được bơm thêm vào các nhà kính để thúc đẩy thực vật phát triển. Thực vật cũng giải phóng ra CO2 trong quá trình hô hấp của nó, nhưng tổng thể thì chúng làm giảm lượng CO2.
Các giới hạn của OSHA cho nồng độ carbon dioxide tại nơi làm việc là 0,5% cho thời gian dài, tối đa tới 3% cho phơi nhiễm ngắn (tối đa 10 phút). OSHA cho rằng các nồng độ trên 4% là "nguy hiểm ngay lập tức đối với sức khỏe và sự sống". Những người thở không khí chứa trên 5% carbon dioxide trên 30 phút có các triệu chứng tăng anhydride carbonic máu cấp tính, trong khi việc thở với nồng độ carbon dioxide từ 7%–10% có thể làm bất tỉnh trong vài phút. Carbon dioxide, dù là dạng khí hay dạng rắn, chỉ được tiếp xúc trong các môi trường/khu vực thông gió tốt.
Xem thêm: Khí máu động mạch.
Khí quyển Trái Đất

Vào thời điểm năm 2004, khí quyển Trái Đất chứa khoảng 0,038% theo thể tích (380 µL/L hay ppm) hoặc 0,053% theo trọng lượng là CO2. Nó tương đương với 2,7 × 1012tấn CO2. Do có nhiều đất đai hơn (và vì thế nhiều thực vật hơn) nên ở bắc bán cầu khi so với nam bán cầu có sự dao động hàng năm vào khoảng 5 µL/L, sự dao động này lên tới đỉnh vào tháng 5 và xuống tối thiểu vào tháng 10 khi kết thúc mùa sinh trưởng ở bắc bán cầu, khi mà khối lượng các chất sinh học trên hành tinh là lớn nhất.
Mặc dù nồng độ thấp nhưng CO2 là một thành phần cực kỳ quan trọng trong khí quyển Trái Đất, do nó hấp thụ bức xạ hồng ngoại và làm tăng hiệu ứng nhà kính.
Carbon dioxide nguyên thủy trong khí quyển của Trái Đất được tạo ra trong hoạt động của các núi lửa; nó là cốt yếu để làm ấm và ổn định khí hậu dẫn đến sự sống. Hoạt động núi lửa ngày nay giải phóng khoảng 130–230 triệu tấn carbon dioxide mỗi năm. Lượng khí này xấp xỉ 1% lượng carbon dioxide do các hoạt động của con người tạo ra.

Từ đầu thời kỳ cách mạng công nghiệp, nồng độ CO2 trong khí quyển đã tăng khoảng 110 µL/L hay khoảng 40%, phần lớn trong số này được giải phóng từ năm 1945 đến nay. Các đo đạc hàng tháng tại Mauna Loa [2] Lưu trữ 2004-12-10 tại Wayback Machine từ năm 1958 chỉ ra sự tăng từ 316 µL/L trong năm đó tới 376 µL/L năm 2003, tổng thể tăng 60 µL/L trong lịch sử 44 năm đo đạc. Các nhiên liệu hóa thạch như than và dầu mỏ bị đốt là nguyên nhân chính trong sự gia tăng của CO2 do con người tạo ra; Sự tàn phá rừng là nguyên nhân thứ hai. Năm 1997, các đám cháy than bùn ở Indonesia có thể giải phóng tới 13%–40% lượng dioxide carbon do nhiên liệu hóa thạch tạo ra. Nhiều công nghệ khác nhau đã được giới thiệu nhằm làm giảm lượng carbon dioxide dư thừa khỏi khí quyển. Không phải toàn bộ lượng CO2 được giải phóng ra tồn tại trong không khí; một số được các đại dương hoặc sinh quyển hấp thụ. Tỷ lệ CO2 tỏa ra trên sự tăng của CO2 trong khí quyển được biết đến như là tỷ lệ bay lên (Keeling và những người khác, 1995); nó dao động theo các trung bình ngắn hạn nhưng thông thường là 57% cao hơn đối với các chu kỳ dài hơn (5 năm).

Thuyết "sự ấm toàn cầu" (GWT) dự báo là sự gia tăng lượng CO2 trong khí quyển có xu hướng làm trầm trọng thêm hiệu ứng nhà kính và vì thế góp phần vào sự ấm toàn cầu. Hiệu ứng của carbon dioxide tạo ra từ sự cháy đối với khí hậu được gọi là hiệu ứng Callendar.
Thay đổi trong quá khứ
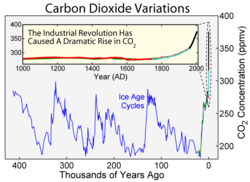
Phương pháp trực tiếp nhất để đo nồng độ carbon dioxide trong khí quyển cho các thời kỳ trước việc lấy mẫu trực tiếp là đo các bọt khí bị giữ lại trong các chỏm băng ở Nam Cực hay Greenland. Nghiên cứu được chấp nhận rộng rãi nhất là từ các loại lấy từ Nam Cực và chỉ ra rằng mức CO2 trong khí quyển là khoảng 260–280 µL/L ngay trước khi khí thải công nghiệp bắt đầu và nó không dao động nhiều với mức này trong khoảng 10.000 năm trước đó.
Ghi chép về lõi băng dài nhất đến từ Đông Nam Cực, tại đó băng được lấy mẫu đến niên đại khoảng 650.000 năm trước. [3] Trong thời gian này, nồng độ carbon dioxide trong khí quyển đã dao động trong khoảng 180–210 µL/L trong các thời kỳ băng hà, tăng lên tới 280–300 µL/L trong các thời kỳ giữa các kỷ băng hà ấm áp hơn.
Một số nghiên cứu đã gây tranh luận về sự ổn định của mức CO2 trong thời kỳ giữa các kỷ băng hà gần đây nhất (10.000 năm cuối). Dựa trên phân tích các lá hóa thạch, Wagner và những người khác cho rằng mức CO2 trong thời kỳ 7–10.000 năm trước là cao hơn một cách đáng kể (≈ 300 µL/L) và chứa các thay đổi đáng kể mà có thể có tương quan với các thay đổi khí hậu. Các tuyên bố khác gây tranh cãi là giả thiết cho rằng chúng có lẽ phản ánh các vấn đề định cỡ hơn là các thay đổi thực sự của CO2. Liên quan đến tranh cãi này là các quan sát lõi băng ở Greenland thông thường cho các giá trị của CO2 cao hơn và biến đổi nhiều hơn so với các phép đo tương tự tại Nam Cực. Tuy nhiên, các nhóm chịu trách nhiệm cho các đo đạc này (ví dụ Smith và những người khác tin rằng các thay đổi trong lõi băng Greenland được tạo ra do sự phân hủy tại chỗ (in situ) của bụi calci carbonat tìm thấy trong băng. Khi mức độ bụi trong các lõi băng Greenland là thấp gần như bằng mức ở lõi băng Nam Cực thì các báo cáo của các nhà nghiên cứu cũng gần như cho một kết quả giữa các phép đo tại hai nơi này.

Trên biểu thời gian dài hơn, các phép đo đại diện khác nhau được sử dụng để cố gắng xác định mức carbon dioxide trong khí quyển hàng triệu năm trước. Các phép đo này bao gồm các tỷ lệ đồng vị bo và carbon trong các dạng trầm tích đại dương nào đó cũng như số lượng khí khổng quan sát được trên các lá hóa thạch. Trong khi các phép đo này ít chính xác hơn về nồng độ carbon dioxide so với việc đo lõi băng thì ở đây có chứng cứ cho thấy các nồng độ CO2 rất cao (> 3.000 µL/L) trong khoảng 600–400 triệu năm trước và trong khoảng 200–150 triệu năm trước.[4] Lưu trữ 2007-04-27 tại Wayback Machine. Trên biểu thời gian dài, hàm lượng CO2 khí quyển được xác định theo cân bằng giữa các quá trình địa hóa học (bao gồm carbon hữu cơ bị chôn vùi trong các trầm tích, đá silicat phong hóa) và tác động của núi lửa. Hiệu ứng ròng của sự không cân bằng nhẹ trong chu trình carbon trên hàng chục đến hàng trăm triệu năm đã làm giảm CO2 khí quyển. Các tốc độ của các quá trình này là cực chậm; vì thế chúng có mối tương quan bị giới hạn đối với các phản ứng của CO2 khí quyển trong việc thoát ra trong hàng trăm năm sau. Trong thời gian gần đây, nồng độ CO2 khí quyển vẫn tiếp tục theo đà suy giảm kể từ khoảng 60 triệu năm trước, và ở đây cũng có chứng cứ địa hóa học cho thấy nồng độ đã nhỏ hơn 300 µL/L vào khoảng 20 triệu năm trước. Nồng độ CO2 thấp có thể đã là tác nhân kích thích cho sự tiến hóa của các thực vật [[Sự cố định carbon C4|C4]], là những loài đã tăng đáng kể về số lượng trong khoảng 7–5 triệu năm trước. Mặc dù các nồng độ CO2 thời đó đã vượt quá trong vòng các kỷ nguyên địa chất diễn ra sớm hơn, các nồng độ carbon dioxide hiện nay có lẽ là cao hơn so với bất kỳ thời gian nào trong vòng 20 triệu năm qua [5] Lưu trữ 2006-07-09 tại Wayback Machine nhưng lại là thấp hơn so với bất kỳ thời gian nào trong lịch sử nếu ta nhìn vào thang thời gian dài hơn 50 triệu năm.
Thủy quyển Trái Đất
Các đại dương của Trái Đất chứa một lượng khổng lồ carbon dioxide trong dạng các ion bicarbonat và carbonat—nhiều hơn rất nhiều so với lượng CO2 trong khí quyển. Bicarbonat được tạo ra trong các phản ứng của đá, nước và carbon dioxide. Dưới đây là ví dụ về sự hòa tan calci carbonat:
CaCO3 + CO2 + H2O ⇌ Ca2+ + 2 HCO3−
Các phản ứng tương tự như thế có xu hướng tạo ra các thay đổi đệm của CO2 khí quyển. Các phản ứng giữa carbon dioxide và các loại đá không carbonat cũng bổ sung thêm bicarbonat vào biển cả, chúng sau đó phản ứng theo chiều ngược lại của phản ứng trên để tạo ra các loại đá carbonat và giải phóng một nửa các bicarbonat thành CO2. Hàng trăm triệu năm qua chúng đã tạo ra một lượng lớn đá carbonat. Nếu tất cả các loại đá carbonat trong lớp vỏ Trái Đất được chuyển hóa ngược lại thành carbon dioxide thì lượng khí này sẽ nặng gấp 40 lần toàn bộ khí quyển.
Phần chủ yếu của CO2 được bổ sung vào khí quyển cuối cùng sẽ bị các đại dương hấp thụ trong dạng các ion bicarbonat, nhưng quá trình này phải mất hàng trăm năm do phần lớn nước biển lại không ở gần bề mặt.
Trong vũ trụ
Carbon dioxide là thành phần chính của khí quyển Sao Hỏa, và là một thành phần quan trọng của khí quyển Sao Kim. Có giả thuyết cho rằng vào thời kỳ hệ Mặt Trời mới hình thành, các hành tinh nằm ở vòng trong (Trái Đất, Sao Hỏa, Sao Kim) đều có khí quyển khá giống nhau và chứa nhiều thán khí. Thán khí cũng có mặt ở dạng băng khô trên các sao chổi.
Chất khí này đã được quan sát là có mặt ở khoảng không vũ trụ, gần những sao thuộc thế hệ 2 hoặc thế hệ 3, nơi mà sản phẩm của quá trình phản ứng nhiệt hạch trong các sao đã tích tụ nhiều carbon và oxy. Có thể đặt giả thuyết rằng chất khí này có mặt trong khí quyển của các hành tinh thuộc vòng trong bay quanh các sao thuộc thế hệ từ 2 trở đi.
Lịch sử
Carbon dioxide là một trong các khí đầu tiên được miêu tả như là chất hiện hữu trong không khí. Vào thế kỷ XVII, nhà hóa học người Flanders là Jan Baptist van Helmont đã quan sát thấy khi ông đốt than củi trong bình kín thì khối lượng còn lại của tro là thấp hơn so với khối lượng nguyên thủy của than củi. Diễn giải của ông là phần còn lại của than củi đã được biến tố thành chất không nhìn thấy mà ông gọi là "khí" hay "linh hồn hoang dã" (spiritus sylvestre).
Các thuộc tính của carbon dioxide được nhà vật lý người Scotland là Joseph Black nghiên cứu nhiều hơn trong thập niên 1750. Ông phát hiện ra là đá vôi (calci carbonat) có thể nung nóng hay xử lý bằng các acid để sinh ra khí mà ông gọi là "không khí cố định". Ông quan sát thấy không khí cố định nặng hơn không khí và không hỗ trợ sự cháy cũng như sự sống của động vật. Ông cũng phát hiện là nó có thể, khi cho chạy qua dung dịch nước của vôi tôi (calci hydroxide) làm kết tủa calci carbonat và sử dụng hiện tượng này để minh họa rằng carbon dioxide là sản phẩm của sự hô hấp của động vật và lên men vi sinh vật. Năm 1772, Joseph Priestley sử dụng carbon dioxide tạo ra từ phản ứng của acid sunfuric với đá vôi để điều chế nước soda, ví dụ đầu tiên được biết của đồ uống carbonat hóa nhân tạo.
Carbon dioxide được Humphrey Davy và Michael Faraday hóa lỏng lần đầu tiên năm 1823 bằng tăng áp suất. Mô tả đầu tiên về carbon dioxide rắn là của Charles Thilorier, là người năm 1834 đã mở thùng chứa carbon dioxide lỏng bị nén, chỉ để tìm sản phẩm được tạo ra do bị làm lạnh vì sự bay hơi nhanh của carbon dioxide lỏng và thấy "tuyết" của CO2 rắn.
Xem thêm
Tham khảo
- Friederike Wagner, Bent Aaby và Henk Visscher (2002) Rapid atmospheric CO2 changes associated with the 8,200-years-B.P. cooling event, PNAS 99 (19): 12011-12014 DOI: 10.1073/pnas.182420699
- Andreas Indermühle, Bernhard Stauffer, Thomas F. Stocker (1999) Early Holocene Atmospheric CO2 Concentrations, Science 286 (5446): 1815 DOI: 10.1126/science.286.5446.1815a Early Holocene Atmospheric CO2 Concentrations Science URL truy cập 26 tháng 5 năm 2005
- H.J. Smith, M Wahlen và D. Mastroianni (1997) The CO2 concentration of air trapped in GISP2 ice from the Last Glacial Maximum-Holocene transition, Geophysical Research Letters 24(1) 1-4
- Joseph Priestley (1772) Observations on Different Kinds of Air, Philosophical Transactions 62: 147-264
- Humphry Davy (1823) On the Applicatin of Liquids Formed by the Condensation of Gases as Mechanical Agents, Philosophical Transactions 113: 199-205
| |||||||||||||||||
| |||||||||||||||||
| |||||||||||||||||
| |||||||||||||||||
| |||||||||||||||||
| |||||||||||||||||
Liên kết ngoài
| Wikimedia Commons có thêm hình ảnh và phương tiện truyền tải về Carbon dioxide. |
- Thẻ an toàn hóa chất số 0021
- CID280 từ PubChem
- Thông tin về băng khô Lưu trữ 2004-04-03 tại Wayback Machine
- Bassam Z. Shakhashiri – Hóa chất trong tuần: Carbon dioxide Lưu trữ 2004-12-10 tại Wayback Machine
- Keeling, C.D. và T.P. Whorf – Ghi chép về carbon dioxide trong khí quyển tại Mauna Loa Lưu trữ 2004-12-10 tại Wayback Machine, 2002
- Cập nhật Mauna Loa 2004
- Carbon dioxide, CO2: Thuộc tính, sử dụng, ứng dụng
- Wiki hóa điện toán Lưu trữ 2006-02-21 tại Wayback Machine
- Biểu đồ pha theo áp suất-nhiệt độ của carbon dioxide Lưu trữ 2008-02-16 tại Wayback Machine
| Số oxy hóa hỗn hợp |
|
|---|---|
| Số oxy hóa +1 |
|
| Số oxy hóa +2 |
|
| Số oxy hóa +3 |
|
| Số oxy hóa +4 |
|
| Số oxy hóa +5 |
|
| Số oxy hóa +6 |
|
| Số oxy hóa +7 |
|
| Số oxy hóa +8 |
|
| Có liên quan | |
Carbon sắp xếp theo số oxy hóa. Thể loại:oxide
| |